

| 22-02-2025 (329 ) | Categoria: Corrosion |
Per entendre la protecció catòdica, primer hem d'entendre el mecanisme de corrosió. Perquè hi hagi corrosió, s'han de complir tres condicions.
Els dos metalls diferents poden ser aliatges totalment dissimilars, com els¬†aliatges d'acer i alumini, per√≤ generalment es tracta m√©s de difer√®ncies metal¬∑l√ļrgiques microsc√≤piques o macrosc√≤piques a la superf√≠cie d'una pe√ßa √ļnica d'acer.
Si existeixen les condicions anteriors en la superf√≠cie met√†l¬∑lica m√©s activa (en aquest cas considerarem l'acer que es corroeix lliurement, que no √©s uniforme), la seg√ľent reacci√≥ ocorre en els llocs m√©s actius (2 ions de ferro m√©s 4 electrons lliures):2Fe = > 2Fe¬†+ + 4e-
Els electrons lliures viatgen a trav√©s del trajecte met√†l¬∑lic cap als llocs menys actius on ocorre la seg√ľent reacci√≥ (Gas oxigen convertit en ion oxigen, en combinar-se amb els quatre electrons lliures, el qual es combina amb aigua per formar ions hidroxil):
O2 + 4e- + 2H20 = > 4 OH-
Les recombinacions d'aquests ions en la superf√≠cie activa produeixen la seg√ľent reacci√≥, la qual produeix el producte de corrosi√≥ del ferro hidr√≤xid ferr√≥s.
2Fe + O2 + 2H2O => 2Fe (OH)2
Aquesta reacció s'explica més comunament com a flux de corrent a través de l'aigua des de l'ànode (lloc més actiu) cap al càtode (lloc menys actiu).
La protecció catòdica atura la corrosió en convertir tots els llocs anòdics (actius) de la superfície metàl·lica en llocs catòdics (passius) mitjançant el subministrament d'un corrent elèctric (o electrons lliures) des d'una font externa.
Generalment això té la forma d'ànodes galvànics que són més actius que l'acer. Aquest mètode també es coneix com a sistema de protecció catòdica per ànodes de sacrifici, ja que els ànodes galvànics se sacrifiquen a si mateixos per protegir l'estructura d'acer o la canonada de la corrosió.
En el cas dels ànodes d'alumini, la reacció a la superfície d'alumini és (4 ions d'alumini més 12 electrons lliures):
4Al = > 4AL + + + + 12 e-
i a la superfície metàl·lica (Gas oxigen convertit en ions d'oxigen que es combinen amb aigua per formar ions hidroxil):
3O2 + 12e- + 6H20 = > 12OH-
Sempre que el corrent (electrons lliures) arribi al càtode (acer) abans que l'oxigen, no hi haurà corrosió.
Figura 1: Sistema de protecció catòdica per ànode de sacrifici en aigua marina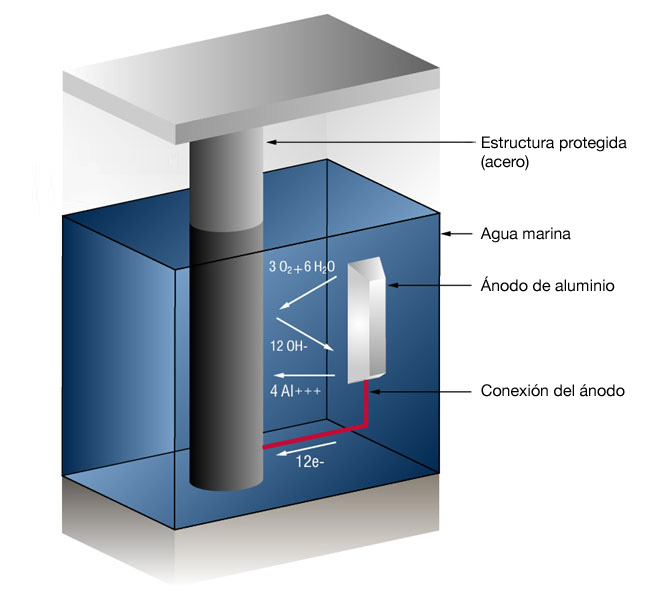
El corrent elèctric que descarrega un ànode és controlat per la llei d'Ohm, és a dir:
I =E/R
On:
I = Flux de corrent en amper
E = Diferència de potencial entre l'ànode i el càtode en volts
R = Resistència total del circuit en ohm
Inicialment, el corrent serà alt atès que la diferència de potencial entre l'ànode i el càtode és alta, però a mesura que la diferència de potencial disminueix degut a l'efecte del flux de corrent cap al càtode, el corrent disminueix gradualment per raó de la polarització del càtode.
La resist√®ncia del circuit inclou tant el trajecte de l'aigua com el trajecte del metall, incloent qualsevol cable que hi hagi en el circuit. El valor dominant en aquest cas √©s la resist√®ncia de l'√†node a l'aigua de mar. Per a la majoria de les aplicacions, la resist√®ncia del metall √©s tan redu√Įda en comparaci√≥ amb la resist√®ncia de l'aigua que es pot ignorar. (Aix√≤ no s'aplica per a tubs o canonades llargues protegides des d'ambd√≥s extrems).
En general, els ànodes llargs i prims tenen menor resistència que els ànodes curts i gruixuts. Aquests descarregaran més corrent, però no duren tant de temps. Per tant, el dissenyador de protecció catòdica ha de determinar la mida dels ànodes de manera que tinguin la forma i l'àrea de superfície correctes per descarregar suficient corrent per tal de protegir l'estructura, i el pes adequat per durar el temps desitjat quan descarreguin aquest corrent.
Com a regla general: La Longitud de l'ànode determina quant corrent pot generar i, per tant, quants metres quadrats d'acer poden protegir-se. La secció transversal (pes) determina durant quant temps l'ànode pot mantenir aquest grau de protecció.
A causa dels alts corrents involucrats en molts sistemes d'aigua marina, no és inusual utilitzar sistemes de corrent forçat. Els sistemes de corrent forçat utilitzen una mena d'ànodes que no es dissolen fàcilment en ions metàl·lics, sinó que mantenen una reacció alternativa: l'oxidació dels ions de clorur dissolts.
2Cl- = > Cl2 + 2e-
Una unitat externa d'alimentació de corrent continu subministra el corrent.
Figura 2: Sistema de protecció catòdica de corrent forçat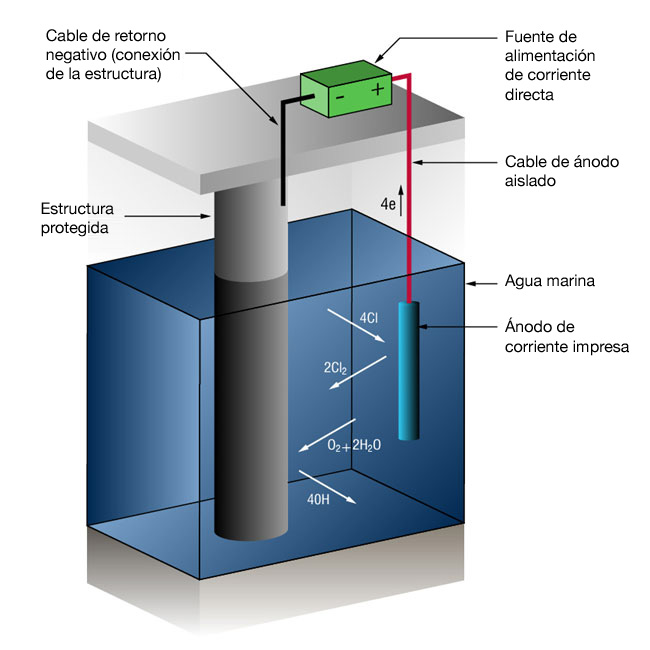
Sabem que tenim o no prou corrent si comparem el potencial de l'acer amb el d'un elèctrode de referència estàndard, generalment un electrode de plata/clorur de plata (Ag/AgCl en aigua marina), però algunes vegades de zinc (Zn en aigua marina).
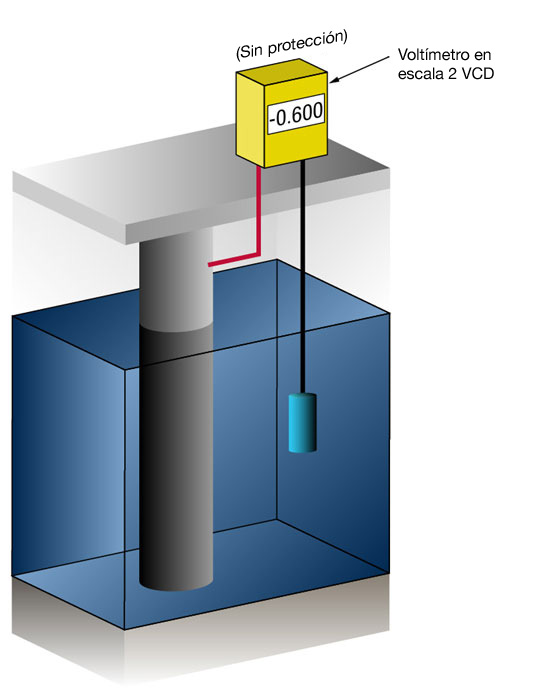
El flux de corrent en qualsevol metall canvia el seu potencial normal en la direcció negativa. L'experiència ha demostrat que si.. l'acer rep prou corrent per canviar el potencial a (-) 0.800 V vs. un electrode de plata/clorur de plata, la corrosió pràcticament s'atura.
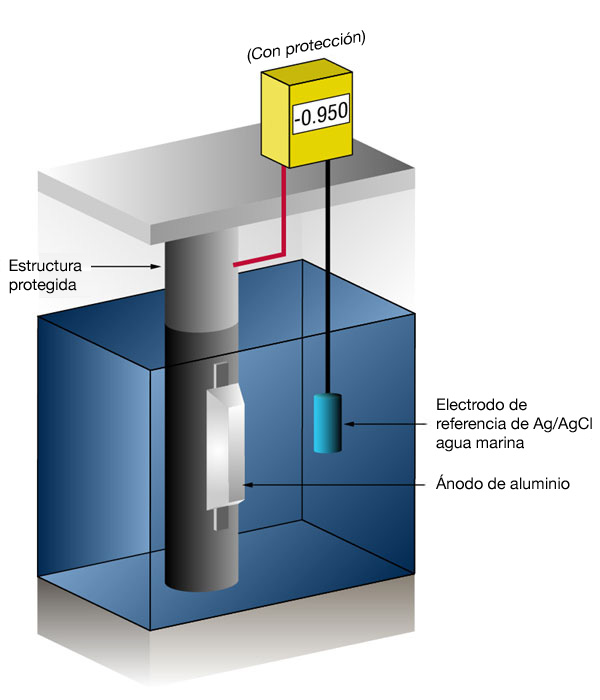
A causa de la naturalesa de les pel·lícules que es formen, el potencial mínim (-0.800 V) és rara vegada el potencial òptim, i els dissenyadors intenten aconseguir un potencial entre (-) 0.950 V i (-) 1.000 V vs. un electrode de Ag/AgCl aigua marina.
 
Figura 3: Mesurament del potencial de protecci√≥ cat√≤dica (Sense protecci√≥ a l'esquerra ‚Äď Amb protecci√≥ a la dreta)
 |
 |